Nytt fra forskning
Det skjer mye rundt om i verden, og noen lovende nyheter kan vi melde om i denne spalten. Først tar vi turen til protonbehandling hvor forskerne ved Shanghai Proton and Heavy Ion Center har gjort seg noen tidlige erfaringer med bruken av partikkelstråling.
Illustrasjon: Colourbox
Mellom juni 2015 og oktober 2018 ble 50 pasienter med glioblastom multiform (n = 34) eller anaplastisk gliom (n = 16) behandlet ved Shanghai Proton and Heavy Ion Center. 24 pasienter fikk protonstrålebehandling i en dose på 60 grayekvivalenter i 30 daglige fraksjoner, og 26 pasienter fikk protonstrålebehandling pluss karbonionstrålebehandling (CIRT) i forskjellige doser. Alle pasienter fikk temozolomid på grunn av deres alder eller deres MGMT promotormetyleringsstatus. Progresjonsfri overlevelse (PFS) og total overlevelse (OS), samt behandlingsinduserte toksisiteter, ble analysert.
Analyser avdekket at alder (> 50 vs. ≤ 50 år), grad 3 mot 4 og Karnofsky-score (> 80 vs. ≤80) hadde betydning for OS, og IDH-mutasjon og grad var viktig for å forutsi PFS. 29 pasienter opplevde grad 1 behandlingsrelaterte akutte bivirkninger, og 11 utviklet grad 1 (n = 6) eller grad 2 (n = 5) sen bivirkning av stråleindusert hjernenekrose. Ingen toksisiteter i grad 3, 4 eller 5 ble observert.
Partikkelstrålebehandling ga 18-måneders OS og PFS på henholdsvis 72,8 prosent og 59,8 prosent, med akseptable bivirkninger hos pasienter med høygradig gliom. Partikkelstrålebehandling i en dose ≥ 60 grayekvivalenter ser ut til å være en sikker og potensielt effektiv behandling.
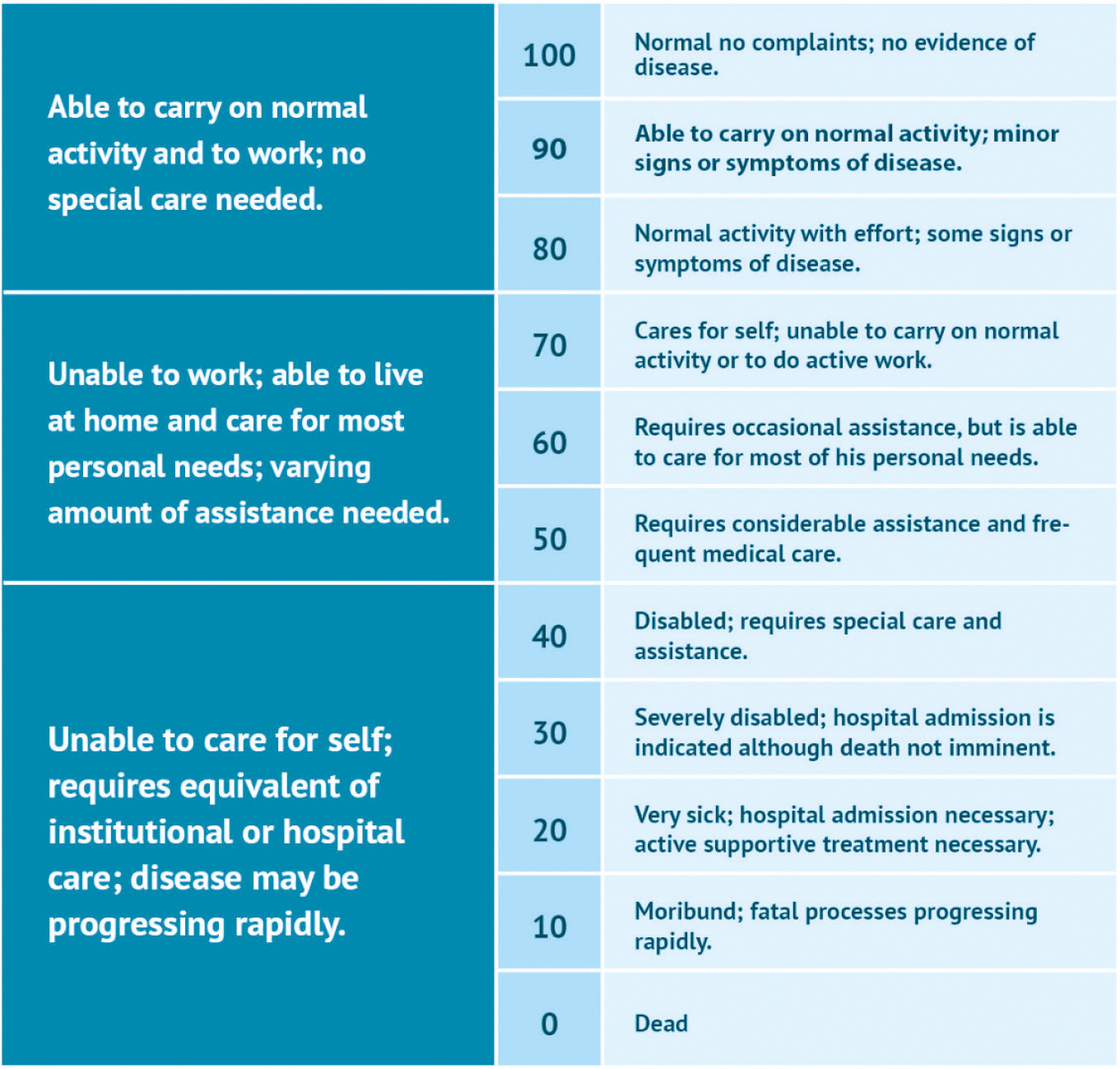
Karnofsky Performance Scale.
Protonbehandling vs. fotonbehandling
Om noen år vil protonbehandling være etablert som et behandlingstilbud i Norge. Det bygges protonstråleanlegg i Bergen og Oslo, for behandling og forskning, Hvilke muligheter får vi med protonbehandling som vi ikke har i dag? Dette er spørsmål som flere enn forskerne stiller seg. For å forstå hva proton- og partikkelstråling representerer, må man ha en viss innsikt i forskjellen mellom dette og fotonstråling som vi i dag benytter i Norge. Hele poenget med stråleterapien er å kunne treffe kjernen av svulsten, hvor det er vanskelig å nå frem med cellegift. Skal man nå denne må man ellers benytte seg av kirurgiske inngrep, noe som kan være svært krevende for pasienten og er også vanskelig å gjennomføre når svulstene sitter kinkig til. De dyktige nevrokirurgene er også forsiktige med å skade friskt vev, hjernen vår er jo uerstattelig og det er vanskelig eller helt umulig å trene opp enkelte funksjoner ved skade.
Det har i løpet av de siste 10–15 årene skjedd en utvikling innen fotonbasert stråleterapi. Det har blitt utviklet teknikker som gjør at det nå i større grad er mulig å avgrense området med høy stråledose til det området som trenger strålingen. Slike teknikker innebærer imidlertid at store områder blir utsatt for middels til lave stråledoser. Dette kan medføre at vi på sikt kan få se konsekvensene av dette i fremtiden, gjennom flere som får kreft pga. denne strålingen. Protoner gjør det derimot mulig å avgrense høydoseområdet uten bestråling av uønsket område med «lekkasjer» fra strålingen. Ved fotoner vil den høyeste dosen avsettes mellom 1,5 til 3 cm fra overflaten, før den minker videre innover i kroppen. Protonstråling gir en lav dose inn til det bestemte punktet hvor dosen raskt stiger til sin maksimale verdi og nærmest bruker opp all energien sin der. Dette skyldes at energien er høyest rett før de stopper opp, og får sin effekttopp der hvor den er ønsket. Denne toppen er oppkalt etter fysikeren William Henry Bragg, som først beskrev dette fenomenet. Braggtoppen (eller Braggpeaken som det gjerne kalles) er svært begrenset og det betyr at området som får høy dose er lite. Ønsker man at effekten skal spres over et større område, så må man endre energien på protonene underveis i behandlingen for å få en såkalt utsmurt Braggtopp og større områder kan dermed behandles under ett.
Et proton er altså en liten partikkel. For den som husker tilbake til naturfagstimene, så ser dere kanskje for dere en atomkjerne med protoner og nøytroner. Det første grunnstoffet i det periodiske systemet er Hydrogen, som har en kjerne med et proton og et elektron som går i bane rundt dette. For å skaffe seg et proton, må man derfor fjerne elektronet fra et hydrogenatom. Da sitter man igjen med en enkelt positivt ladet partikkel, som sammen med andre kan gis økt fart og styres ved hjelp av magnetfelt. Dette er i utgangspunktet ikke langt unna måten man laget bilder på gamle TV-apparater. De hadde et såkalt katodestrålerør, hvor elektroner ble styrt i stråler mot skjermen hvor de tegnet linjer i et bestemt mønster som til sammen utgjorde et bilde. Når det gjelder protonene i behandlingen av kreft, så er det altså et spørsmål om hvor dypt de skal nå og hvordan de skal styres for å treffe der onkologene sikter seg inn mot.
Mens TV-skjermen stoppet elektronene, så er det altså slik at det er ingen klar vegg som stopper protonene i f.eks. hodet vårt. Skal man dra nytte av at man har denne Braggtoppen og nærmest ingen stråling bak denne, så må det beregnes nøye hvor denne skal være. Siden vi i Norge ikke har stor erfaring med dette, så er det også nødvendig at det forskes på dette. Det finnes flere usikkerhetsmomenter som må klarlegges for å sikre rett behandling. Disse usikkerhetene må avklares slik at anatomien og behandlingsplanen, terreng og kart om du vil, stemmer overens. Dette krever at de maskinene som benyttes for å undersøke pasientene før behandling, må være finkalibrerte og sikre i sin posisjonsangivelse. Selv etter en slik kalibrering, er det fortsatt muligheter for avvik. Avviket reduseres gjerne ved bruk av en spesiell CT-maskin, som benytter seg av to forskjellige røntgenkilder.
Stråledoser som gjerne måles i gray som er Joule/kg, forteller oss hvor mye energi som avsettes i vevet. Avhengig av hvilken type stråling det er snakk om, så har 1 gray varierende biologisk effekt på vevet. Vanligvis er det Co60-kilder som brukes for fotoner (kobolt har plass nummer 27 i det periodiske systemet og denne isotopen av kobolt brukes i strålebehandling), mens det for protoner er vanlig å bruke en faktor på 1,1, dvs. at protoner er ti % mer effektive enn fotonene. Dette er et anslag som er nokså pragmatisk, og bare forskning kan fortelle oss om dette er korrekt.
Det er to forskjellige teknikker for protonstråling: Intensity Modulated Proton Therapy (IMPT) eller Single Field Uniform Dose (SFUD). Ved IMPT vil det summen av strålingen fra alle felt gi en jevn stråledose til svulsten mens hvert enkelt strålefelt ikke vil gjøre det. Ved SFUD-teknikk vil hvert enkelt felt gi en jevn stråledose til svulsten. Det meste av den kliniske erfaringen som finnes på Pencil Beam Scanning i dag er bygget på behandling med SFUD. IMPT ligner derfor mer på gammaknivbehandling, hvor mange forskjellige strålefelt møtes i ett punkt. Med egen kapasitet på protonstråling kan vi se frem til ny viten. Frem til dette er våre forskere og behandlere nødt til å hente slik kunnskap fra utlandet. Både ved Radiumhospitalet og Haukeland universitetssykehus graves det nå dypt for å få plass til de enorme konstruksjonene et protonstråleanlegg krever, og om noen få år vil de første pasientene behandles med protonstråling i Norge.
Illustrasjonsfoto: Colourbox
De slue gliomene
«I noen henseender viser gliomer Machiavelliansk oppførsel», sier dr. Benjamin Deneen. Machiavellian, med sin list og brutalitet, kommer fra den italienske filosofen Niccolò Machiavelli som på 1500-tallet skrev om at hensikten rettferdiggjør midlene, særlig blant politikere. Deneen, som er professor i nevrokirurgi ved Center for Stem Cell and Regenerative Medicine ved Baylor College of Medicine, refererte til det fascinerende beviset han og kollegene avdekket om hvordan gliomer manipulerer omgivelsene på måter som favoriserer dens egen vekst. Denne forskningen, publisert i Nature, antyder at det vil være nødvendig med nye strategier for å behandle pasienter med denne tilstanden, en av de mest aggressive ondartede primære hjernesvulstene.
Det opprinnelige målet med denne studien var å utvikle et eksperimentelt system som ville gjøre det mulig for forskere å identifisere nye kreftgener i musemodeller av hjernesvulster. For å oppnå dette målet startet et samarbeid mellom Deneen-laboratoriet og Baylor-medforfatter dr. Kenneth L Scott. Sammen konstruerte de genetisk sin musemodell av gliomer til en ny forskningsplattform med høy gjennomstrømning for å identifisere varianter av PIK3CA-genet som er drivende for tumorutvikling. Ved å bruke sin nye forskningsplattform oppdaget forskerne flere varianter av PIK3CA som drivende for gliomutvikling. To av PIK3CA-variantene, kalt C420R og H1047R, skilte seg ut fordi de var de sterkeste driverne for tumorutvikling. Interessant nok er noen av genene som er spesifikt uttrykt i C420R og H1047R gliomer, involvert i synapsedannelsen, det vil si veikryssene mellom nevroner som de kommuniserer gjennom, noe som tyder på at svulstene kan påvirke den synaptiske balansen i nabonevroner. Disse genvariantene produserer proteiner som bare skiller seg i en aminosyre, byggesteinene til proteiner, men noen av variantene genererer svulster med molekylære profiler som er ganske forskjellige fra de andre.
For å undersøke disse forskjellige mekanismene, fokuserte Deneen og kollegene på de synaptiske gensignaturene, og antok at disse endringene i synaptisk genuttrykk kan føre til bl.a. anfall og direkte synaptiske endringer i deres musemodell. For å gjennomføre disse studiene, samarbeidet Deneen med medforfatter Dr. Jeffrey L Noebels, professor i nevrologi, nevrovitenskap og molekylær og human genetikk og Cullen Trust for Health Care Endowed Chair in Neurogenetics ved Baylor.
Det er enighet om at synaptisk ubalanse kan føre til omfattende endringer i nevronale nettverkstilkoblinger og eksitabilitet (reagerer på stimuli), noe som i noen tilfeller kulminerer med anfallsaktivitet», sier Deneen. Anfall er typisk for gliomer, men de underliggende cellulære og genetiske mekanismene er ikke godt forstått. Vi benyttet dette funnet som en mulighet til å se på om forskjellige PIK3CA-varianter kan indusere epilepsi i gliomer og også for å forstå mer om mekanismene som svulster fremmer nevronalt. Studiene deres viste at gliomer drevet av C420R og H1047R varianter fremmer tidlig utbrudd av hypereksabilitet i nevroner som omgir svulsten og omformer synaptiske nettverk ved å indusere synapsedannelse. Mus med disse svulstene hadde anfall som dukket opp mye tidligere enn hos mus som hadde svulster drevet av andre PIK3CA-varianter. Når de dykket dypere ned i mekanismene som medierer effekten av C420R og H1047R-gliomer på deres mikromiljø, oppdaget forskerne at disse gliomene selektivt utskilte flere molekyler i glypican (GPC)-familien og at GPC3 drev hypereksabilitet og synaptisk ombygging. Videre fant de ut at GPC3 i seg selv kan være drivende for dannelse av gliomer.
Forskerne har avdekket en sentral mekanisme der gliomer endrer nevroner for å etablere miljøforhold i hjernen som støtter vekst. Terapeutisk undersøkte de aktivt hvordan kortslutning av gliom-til-nevron-kommunikasjon kan brukes til å behandle pasienter med disse ondsinnede hjernesvulstene. Nå gjelder det bare å få overført denne kunnskapen fra musemodeller til mennesker og se at menneskehjernen har samme funksjon.
Oppstart av forskningsprosjekter etter covid-19-stopp
Som et resultat av de strenge tiltakene som ble påført i forbindelse med pandemien, ble kliniske studier utsatt eller inkludering av nye pasienter ble satt på pause. Etter at helsemyndighetene nå har skaffet seg større innsikt i risiko og farer ved pandemien og smitte, så er situasjonen i Norge nå i ferd med å normalisere seg. Dette medfører at nye pasienter får tilgang til utprøvende behandling, og at flere forhåpentligvis får lengre og bedre liv. Er du en som ønsker å delta i en klinisk studie, ta kontakt med din lege for å undersøke muligheten for å bli med i en av de løpende eller fremtidige studiene som kommer.
Flere kliniske studier ønskes gjennomført
Slutten av mai er på mange måter en hektisk periode for forskerne og Hjernesvulstforeningen. Kreftforeningens søknadsfrist for forskningsmidler går ut i starten av juni, og flere forskere tar kontakt for å få påtegninger og brukerrepresentanter til sine prosjekter som de ønsker å søke midler til. Som i fjor, er det ventet at hjernekreft vil være blant de områdene som prioriteres fra Kreftforeningens side, når det gjelder tildeling av forskningsmidler.