Tumorbiologi – sett gjennom en kybernetikers øyne
Etiologi er læren om sykdommenes årsaker. Patogenese er læren om hvordan sykdommer oppstår og utvikler seg. En sykdom kjennes først ordentlig når så vel etiologi som patogenese er avklart.
Denne artikkelen tar for seg mange begreper som er kompliserte å forstå. Mye av informasjonen er hentet fra Helsedirektoratets handlingsprogram for diffuse høygradige gliomer eller tilsvarende kilder, og har et språk som er beregnet på leger. Jeg vil forsøke å forklare kompliserte begreper i et klarere språk, og jeg håper at den som leser dette får en økt forståelse for hvor komplisert kreftsiden av sykdommen er. Den nevrologiske delen av sykdommen vil ikke bli berørt i denne artikkelen, den kommer i tillegg med sine tap av kognitiv og fysisk kapasitet. Artikkelen er ment som en støtte til å forstå sykdom og mulige behandlingsmetoder, samt opplyse aktører i samfunnet om hvor vanskelig det er å diagnostisere og behandle slik sykdom. Det er ikke uten grunn at høygradige hjernesvulster er fryktet blant folk flest, og at overlevelsen er blant de laveste innenfor kreftområdet.
Det å gjette på en løsning er ikke godt nok, analyse må til for å vite nok om valg av behandling..
Illustrasjonsfoto: Colourbox
Når det kommer til den vanligste varianten av hjernekreft, glioblastom, er det så store forskjeller at man kan nesten snakke om at det er flere enn en diagnose. Glioblastom er den høygradige og verste utgaven av gliomer, og er bare en av flere diagnoser som har svært begrenset behandlingsmulighet og er forbundet med lav overlevelse i et femårsperspektiv. For å forstå hvordan alt virker sammen, er det kanskje greit med en gjennomgang av de forskjellige mutasjonene, polymerase, kinase, inhibitorer og annet som legene må finne ut av og jobbe med for å få en mest mulig effektiv behandling av sykdommen.
Først og fremst; IDH er et begrep som står sentralt. Mutasjoner i genet isositratdehydrogenase (IDH) kan forandre (transformere som leger gjerne sier) lavgradige gliomer til glioblastomer. IDH-mutasjoner har vist seg å være gunstig for pasienten, da dette har mye å si for muligheten for livsforlengende behandling med Temodal, cellegiften som er en del av Stupp-protokollen. I WHOs klassifikasjon av hjernesvulster fra 2016 – CNS WHO 2016 (og som blir erstattet av en ny i disse dager), er molekylærgenetiske markører integrert i diagnosene. Det er særlig innenfor hovedgruppen diffust infiltrerende astrocytære og oligodendrogliale hjernesvulster at det i henhold til WHO-klassifikasjon stilles krav til integrerte diagnoser som angir både histopatologiske og molekylærgenetiske funn. Mutasjonsstatus for IDH1 og IDH2 samt 1p/19q-kodelesjon (tap av kromosomarmene 1p og 19q) er nå tatt inn i klassifikasjonen av disse svulstene. Dette fordi disse molekylærgenetiske egenskapene er vist å ha betydning for biologisk utvikling og prognose i større grad enn histologisk klassifikasjon (vevslære / mikroskopisk anatomi) alene.
Kompliserende sammensetning
Sagt i klart språk; det er nødvendig med en genomsekvensering for å finne ut hvilken tumorbiologi legene står overfor når de skal velge behandling etter at mest mulig er fjernet gjennom kirurgi. Uten en slik genomsekvensering, er det bare å sette i gang med Stupp-protokollen og gi strålebehandling og Temodalkurer, og så vente i noen måneder og se på MR-bildene om det har hatt resultater som ønsket. Det sier seg selv at dette ikke er særlig presist, og legene må som oss kybernetikere vite mest mulig om hvilket system og hvordan det best kan reguleres, når de skal velge sine reguleringsmetoder og -parametre settes. Høygradig hjernekreft er ikke som Lotto – her er det analyser og valg av metoder som bestemmer utfallet.Målet er å bedre skille tumorgrupper med ulik prognose og med dette optimalisere behandlingen. Det kan dreie seg om svært store forskjeller innenfor en og samme svulst, såkalt intratumoral heterogenitet, og dette må også tas med i den vurderingen. Heterogeniteten her betyr at det er blanding av både lavgradige og høygradige kreftceller i samme svulsten. Det betyr også at deler av svulsten vil kunne ha god effekt av en type behandling som ikke har effekt på andre deler av svulsten. Når de «enkle» delene av svulsten behandles og kreftcellene der dør, er det dessverre også fritt frem for resten av kreftcellene til å ta til seg all næringen og slippe å konkurrere med de lavgradige kollegene sine. «hjemme-alene-festen» er et faktum, og sterkere lut trengs for å bli kvitt flekkene på MR-bildene.
Når det gjelder diffust infiltrerende (som vokser inn i annet hjernevev i motsetning til f.eks. meningeom som holder seg i hjernehinnen og «bare» presser på annet vev) høygradige gliomer er det følgende diagnoser som er aktuelle:
Anaplastisk astrocytom, IDH-mutert
Anaplastisk astrocytom, IDH-wt (villtype)
Anaplastisk astrocytom, NOS (not otherwise specified)
Glioblastom, IDH-mutert
Glioblastom, IDH-wt
Glioblastom, NOS
Anaplastisk oligodendrogliom, IDH-mutert og med LOH 1p/19q
Anaplastisk oligodendrogliom, NOS
Diffust midtlinjegliom, H3 K27M-mutert
Som vi ser her går IDH igjen, enten som mutasjon eller villtype. IDH-mutert er et høygradig diffust gliom med mutasjon i ett av genene IDH1 eller IDH2. IDH-wt (villtype) har ikke mutasjoner i IDH1 eller IDH2, men viser andre molekylærgenetiske forandringer som f.eks. TERT-promotor mutasjoner, endringer i EGFR, tap av kromosomarmene 10p og/eller 10q kombinert med tap av kromosom 7, homozygot delesjon av CDKN2A/CDKN2B, PTEN-mutasjoner og TP53-mutasjoner. (Sagt i klart språk så er de altså mye mer kompliserte og vanskeligere å behandle.) De regnes derfor som en egen tumorgruppe uavhengig av IDH-muterte diffuse gliomer, og betegnes også «primært glioblastom». Noen av disse svulstene kan vise hovedsakelig eller betydelig epiteloid, sarkomatøs eller kjempecelledifferensiering. De kalles da epiteloid glioblastom, gliosarkom eller kjempecelleglioblastom, uten at det har vesentlig betydning for behandling eller prognose. For de fleste IDH-wt glioblastom er prognosen med gjeldende terapi dårlig. Bestemmelse av MGMT-promotor metyleringsstatus i disse svulstene kan gi avgjørende informasjon om behandlingseffekt og prognose. Det kan skrives mye mer om IDH, men da graver jeg meg nok for langt ned i materien (om jeg ikke har gjort det allerede).
MGMT, metylert eller umetylert; det er da gjerne spørsmålet som legen må ha svar på. MGMT (O6-metylguanin-DNA-metyltransferase) er et protein som fjerner alkyl-grupper fra O6-alkylguanin og således reduserer effekt av alkylerende kjemoterapi (Temodal). Epigenetisk «silencing» ved MGMT-promotor hypermetylering («metylert MGMT») fører til redusert transkripsjon av proteinet og har vist seg å være både prognostisk og prediktivt for økt effekt av Temodal ved glioblastom, også hos eldre pasienter. Det er også vist at MGMT-promotor hypermetylering er en positiv biomarkør for behandling med alkylerende kjemoterapi hos pasienter med IDH-wt høygradig diffust gliom (grad III og IV), men ikke for IDH-mutert høygradig diffust gliom. I Norge pågår det pr. i dag en klinisk studie som undersøker effekten av Bortezomib tatt i forkant og sammen med Temodal, for å gi de som har umetylert MGMT-status bedre effekt av Temodalbehandlingen. Noen av funnene i denne kliniske studien er publisert, og vi ser her at Bortezomib har en effekt og at pasientene tåler den godt. Dette har gitt livsforlenging i form av måneder og kan representere en ny behandlingslinje som gir legen mer tid, men er altså ikke for en endelig kur å regne. Høygradige hjernesvulster er skikkelig tøffe og har en svært god evne til å forandre seg, for å overleve legenes forsøk på å ta knekken på dem.
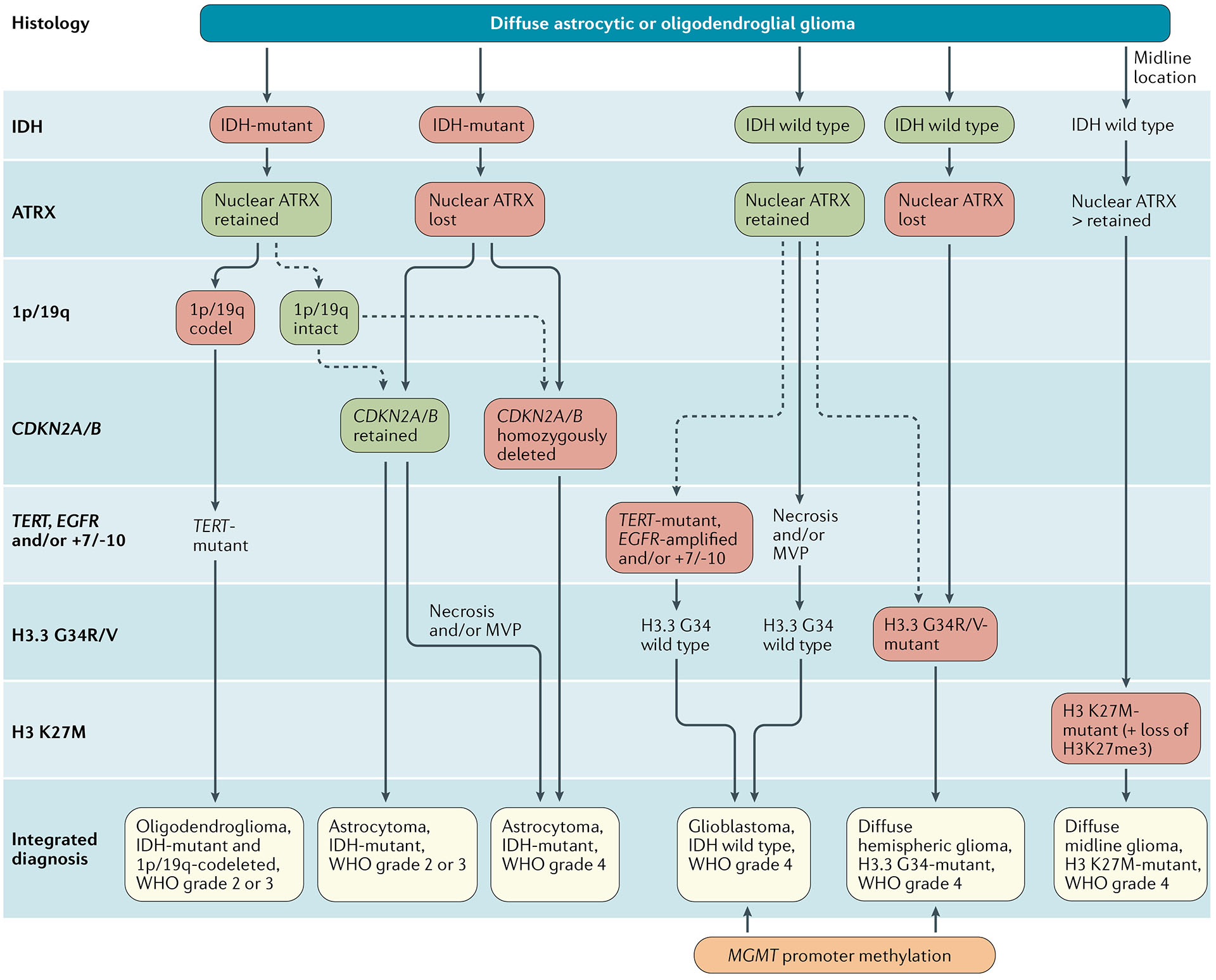
Diagnostisk algoritme for integrert klassifisering av de store diffuse gliomene hos voksne. Vevsprøver hentet ut gjennom biopsiprøvetaking hos pasienter med diffuse gliomer blir rutinemessig vurdert ved immunhistokjemi for tilstedeværelsen av R132H- mutant IDH1 og tap av nukleær ATRX. Hos pasienter i alderen >55 år med en histologisk typisk glioblastom, uten et eksisterende gliom av lavere grad, med en ikke-midtlinje tumorplassering og med beholdt kjernefysisk ATRX-uttrykk, immunhistokjemisk negativitet for IDH1 R132H er tilstrekkelig for klassifiseringen som IDH-villtype glioblastom 1. I alle andre tilfeller av diffuse gliomer bør mangel på IDH1 R132H immunopositivitet følges av IDH1 og IDH2 DNA-sekvensering for å oppdage eller utelukke tilstedeværelsen av ikke-kanoniske mutasjoner. IDH- villtype diffus astrocytiske gliomer uten mikrovaskulær spredning eller nekrose bør testes for EGFR-amplifikasjon, TERT-promoter mutasjon og en +7/–10 cytogenetisk signatur som molekylære egenskaper ved IDH-villtype glioblastomer2. I tillegg, tilstedeværelsen av histon H3.3 G34R/V-mutasjoner bør vurderes ved immunhistokjemi eller DNA-sekvensering for å identifisere H3.3 G34-mutante diffuse hemisfæriske gliomer, spesielt hos unge pasienter med IDH-villtype gliomer (som f.eks. som de <50 år med nukleært ATRX-tap i tumorceller). Diffuse gliomer i thalamus, hjernestamme eller spinal ledningen bør evalueres for histon H3 K27M-mutasjoner og tap av kjernefysisk K27-trimetylert histon H3 (H3K27me3) for å identifisere H3 K27M-mutante diffuse midtlinjegliomer. Tilstedeværelsen og fraværet av det diagnostisk mest relevante molekylære endringer for hver tumortype er uthevet med røde og grønne bokser. MVP, mikrovaskulær spredning.
Figur: EANO guidelines on the diagnosis and treatment of diffuse gliomas of adulthood, Clinical Oncology 18/2021
Cellegift eller immunterapi?
Det har lenge vært kjent at LOH (loss of heterozygosity) på kromosomarmene 1p og 19q er assosiert med bedre overlevelse og bedre respons på kjemoterapi og strålebehandling for pasienter med anaplastiske diffust infiltrerende gliomer. Kombinert tap av 1p og 19q (kodelesjon) sammen med mutasjoner i IDH finnes ifølge CNS-WHO 2016 i alle oligodendrogliomer hos voksne. Etter CNS WHO 2016 skal også gliomer som morfologisk (innen medisin er morfologi læren om struktur, oppbygning og form på vev, organer og individer) fremstår som diffust infiltrerende astrocytomer nå klassifiseres som oligodendrogliomer dersom det foreligger samtidig kodelesjon for 1p/19q og IDH-mutasjon. Når man så har kommet frem til hva man står overfor, så er det på tide å velge behandlingsmetode(r). Hvordan skal kreften bekjempes? Stupp-protokollen er nevnt tidligere. Den innebærer at pasienten etter kirurgisk inngrep har fått fjernet mest mulig av tumorvevet får sine strålebehandlinger med så mye stråling som er trygt å gi, basert på pasientens alder og allmenntilstand, samt cellegiftkurer med Temodal. Noen høygradige hjernekrefttyper responderer bedre på såkalte PCV-kurer. PCV er en kombinasjonskur som består av de tre cellegiftene Lomustine (CCNU®), Procarbazin (Natulan®) og vinkristin.
Når det gjelder hva slags behandling som kan ha effekt, spiller altså det genetiske stor rolle ved valg av kjemoterapi som har effekt. Har man ikke forutsetningene for bruk av de cellegifttypene som vi har normalt benytter i dag, så må vi enten finne frem til andre typer eller gi tilleggsbehandling slik at cellegiften har effekt. Ikke alle medikamenter klarer å passere blod-hjerne-barrieren, men også her har vi i dag stoffer som kan benyttes til å åpne opp denne for et kortere tidsrom, slik at medikamenter kommer gjennom. Uten at jeg har fått det bekreftet av leger, så legger jeg til grunn at dette også er en risikabel prosedyre, da andre ting som vi så absolutt ikke ønsker gjennom denne barrieren kan trenge gjennom når den åpnes. Dette er altså noe som må benyttes under streng kontroll, for å ikke skape andre problemer for oss.
Tradisjonell cellegift må kanskje også vike plassen for CDK-hemmere. For f.eks. glioblastom er det kjent at CDK 12/13 er en del av den komplekse sammenhengen. THZ531 er et eksempel på en slik CDK-hemmer som det nå arbeides med for å prøve ut effekten på glioblastomer med. Foreløpig er det utfordringer med å få de gode resultatene fra laboratoriet over til klinisk effekt under behandling, men det å angripe de såkalte hjernesvulstskapende cellene (brain tumour initiating cells – BTIC) kan være en vei å gå fremfor å velge en annen behandlingsvei. I den komplekse virkeligheten med så stor grad av heterogenitet, må vi nok fortsatt drive litt med å gjette på løsninger og så se om de virker så godt som vi tror. Sånn er det med forskning, det man allerede har av kunnskap brukes til å jobbe videre med problemene for å se om det hjelper oss videre. Puslespillet legges en bit av gangen.
Kunnskap, ikke overtro
Det er heller ikke fritt for at det dukker opp hypoteser om alternative behandlingsformer fra tid til annen.I slike behandlingsformer er det mye håp for enkelte, og håp kan også ha en sterk positiv effekt. Jeg er dog som kybernetiker med sterk tro på det naturvitenskapelige ikke overbevist om at generelle kurer basert på grønnsaker, vann med «magiske» evner eller annet er det som er effektive kurer for et stort og omfattende kreftområde. Gode historier som overleveres i beste mening om noen som fulgte en spesiell diett under kreftbehandlingen og ble frisk sier ikke noe om at det var dietten som gjorde utslaget. Historien har ikke i seg noen genomsekvensering, og blir like lite representativ som historier om en enkelt som mener at han overlevde å kjøre ut i vannet på grunn av at han ikke hadde setebeltet på. Vi må anvende en viss grad av kritisk tenkning, samtidig som at vi er åpne for at det ligger løsninger nærmere oss enn det vi kanskje tror. Noen ganger snubler også forskerne over sine funn, nærmest som et rent tilfelle av flaks på laboratoriet. Det som lar seg gjenskape av resultater er viktige skritt videre for å få kunnskap. Enten det virker eller ei, så lærer man noe av det.
Dessverre så er menneskekroppen så komplisert og full av celler som kan leve sitt eget liv og beskytte seg mot behandling, at det er vanskelig å finne frem til behandlinger med god og varig effekt. Spesielt gjelder dette altså de sykdommene som skyldes mutasjoner. Sjeldne diagnoser er vanskeligere å forske på, da det er færre pasienter å forske på. Dette er til forskjell fra min enkle bakgrunn hvor det stort sett har vært elektronikk, vann eller luft som har vært det som skulle reguleres. Elektroner på vandring endrer ikke plutselig sin polaritet, vann endrer ikke egenskaper og luften er stort sett ganske lik, uavhengig av mindre endringer av innhold av de forskjellige gassene. Kroppen er et komplekst samspill, og det som skjer i hjernen er nok det mest kompliserte av alt. For en storvokst kar som meg, utgjør hjernen bare ca. én prosent av kroppsvekten, men det er den som sørger for at alt annet henger sånn noenlunde sammen og fungerer. Denne viktige prosenten med milliarder av celler som hver enkelt er koblet sammen med ca. 10 000 andre hjerneceller, er det som både gir oss vår intelligens, personlighet, kunnskap, evner og minner. Derfor er også reguleringen av det som foregår i vår hjerne så enormt viktig. Også når det gjelder reguleringen av celler som har snudd seg mot oss, og prøver sitt beste for å ta livet av oss.
Nå til dags er det altså større grad av reguleringsteknikk inn i medisinen når det gjelder kreftbehandling. For en kybernetiker som meg har det lenge vært vanskelig å forstå hvorfor det ikke har vært større bruk av tverrfaglig kompetanse. Med ny klassifikasjon og økt fokus mot biomarkører forstår jeg mer av de valgene som tas. Hvis en dieselmotor ikke vil starte, hjelper det ikke å helle bensin på tanken selv om de begge er forbrenningsmotorer. Det er i bunn og grunn det samme med kreftbehandling også. Behandlingen må ta utgangspunkt i det spesifikke etter en grundig feilsøkning.